从酵母中提取蛋白质:科瓦里斯自适应聚焦声学™(AFA)流程与传统珠磨法和探针超声法的比较
概述
本研究比较了几种基于机械法的裂解与提取技术——包括自适应聚焦声学(AFA)、探针超声法和珠磨法——从酵母中提取蛋白质的效率,评估指标包括:(i)总蛋白得率,(ii)酶活性的保留,(iii)蛋白质的片段化程度,以及(iv)蛋白质偏好性(即未能成功提取特定蛋白质的情况)。蛋白质偏好性通过SDS PAGE分离和二维凝胶电泳(2-DE)分析所鉴定的蛋白质数量及相对丰度来确定。
引言
酿酒酵母细胞壁具有极高的机械强度,这使得提取其蛋白质,尤其是具有生物活性的蛋白质,变得极具挑战性。常用于改善细胞裂解的技术往往涉及剧烈的机械搅拌和/或苛刻的化学试剂,这可能导致蛋白质变性和活性丧失。另外,使用酶(如溶菌酶)水解细胞壁可能导致细胞壁蛋白的丢失,并消除蛋白质的翻译后修饰(如糖基化)[1]。更棘手的是,溶菌酶处理法可能偏向于回收胞质蛋白[2]。
通常,对于坚硬、难破壁的细胞,会使用珠磨法或探针超声法等剧烈的机械方法,然而这两种方法都会产热。(注:尽管水浴超声仪的声压密度低、效率差,但仍被使用。声学过程空化效应所需的总能量也会导致不期望的热量产生。)这些机械技术存在两个固有局限:1)重复性不高,而高重复性是高级生物分析(如基于质谱的模式识别)的重要前提;2)缺乏精确的温控,在需要保持蛋白质天然构象和活性的条件下,可能导致显著的变性、聚集和沉淀损失。此外,探针超声法已被证明会导致蛋白质片段化[3],这很可能是由于探针末端与样品直接接触处产生极端压力和温度所致。另外,探针超声法产生的样品气溶胶化也构成严重的生物危害,已有实验室获得性感染的报道[4,5]。
传统裂解和提取过程中产生的不可控温度是不利的。在高温下进行蛋白质提取会面临Asp-Pro键断裂的风险,尤其是在对温度敏感的Tris缓冲液中[6]。过热还会导致二硫键连接的胱氨酸和游离半胱氨酸发生脱硫反应,分别转化为脱氢丙氨酸和丙氨酸[7]。
与珠磨法和探针超声法无法控制产热的显著对比在于,基于科瓦里斯AFA的提取方案能够精确控制机械能和热能,从而实现高度可重复的裂解与提取。AFA通过高效、非接触、等温的机械破碎方式裂解细胞,实现了极高的提取重复性,同时消除了可能改变或损伤蛋白质的温度波动。AFA过程的能量还可以根据所需目标进行调节。
方法与材料
酵母培养
将0.35克活性干面包酵母(ConAgra, Naperville, IL)水合于40 mL 80 mM蔗糖溶液中,在20°C、300 rpm振荡培养3小时。细胞经800 x g离心1分钟收集沉淀,用40 mL H2O洗涤,再次离心收集沉淀。将细胞重悬于20 mL H2O中,取一份样品用PBS按1:1000稀释,使用Scepter 2.0自动细胞计数器(Millipore, Danvers, MA)进行细胞计数。在第二次洗涤时加入Halt™和EDTA蛋白酶抑制剂(Thermo Scientific Pierce Biotechnology, Rockford, IL, USA),细胞经1000 x g离心2分钟收集沉淀。最后将细胞重悬至终浓度为10^9 细胞/mL。
AFA、珠磨法和探针超声法
为最小化化学效应并分离出AFA、探针超声法和珠磨法的机械效应,在非变性条件下进行比较。将细胞重悬于科瓦里斯N型试剂中,并分装到多个milliTUBE(Covaris, Woburn, MA, USA)中。AFA处理在科瓦里斯M220聚焦超声仪中进行。探针超声处理使用配备阶梯式微尖端的Branson 450 Sonifier(Branson Ultrasonics Corporation, Danbury, CT)进行。AFA和探针超声均归一化至75W峰值入射功率(PIP),10%占空比(DC),在设定温度4°C下处理0、90或180秒。
珠磨处理在FastPrep™(MP Biomedicals, Solon, OH, USA)中进行,使用预填充了Lysis Matrix B硅珠的管子,在设定温度4°C下处理0、90或180秒。
所有样品处理体积均为1 mL。
总蛋白与磷酸酶活性测定
使用Quickstart™ Bradford试剂(BioRad, Hercules, CA)测定蛋白质浓度。使用总磷酸酶检测试剂盒(G-Biosciences, St. Louis, MO, USA)测量磷酸酶活性。在活性测定前,样品中补充10 mM MgCl2。
二维凝胶电泳
在等电聚焦(IEF)前,使用Amicon UltraFREE 0.5 mL、3,000 Da截留分子量的离心过滤装置(Millipore, Danvers, MA),将每个样品置换到科瓦里斯TP型试剂中。用5 mM三丁基膦还原蛋白质二硫键,并用10 mM丙烯酰胺进行烷基化。如前述方法[1],还原和烷基化直接在过滤装置中进行。对截留物进行蛋白质定量,并将样品按蛋白质质量进行归一化。用200 uL样品水化非线性固定化pH梯度胶条(pH 3-10),等电聚焦(IEF)在Protean i12™ IEF仪器(BioRad, Hercules, CA)中进行。第二维PAGE在Criterion™ 8-16% Tris-HCl胶上进行。凝胶用SYPRO Ruby™荧光染色(Invitrogen, Carlsbad, CA)进行图像分析,或用胶体考马斯亮蓝染色以指导手动切取蛋白点用于LC-MS分析。
结果与讨论
使用探针超声法和珠磨法处理的样品,其温度在处理过程中显著升高。在最大功率下,探针超声样品在90秒内达到30°C,在180秒内达到43°C。当功率归一化至75W时,探针超声样品温度在90秒内达到19°C,在180秒内达到27°C。在最低转速下,珠磨处理的样品温度在90秒内达到21°C,在180秒内达到29°C。在最高转速下,珠磨处理的样品温度在90秒内达到64°C,在180秒内达到83°C(图1A)。相比之下,在75W下处理180秒,经AFA处理的样品温度升高不到4°C。
探针超声法的总蛋白得率比AFA法高出约20%,比最低转速下的珠磨法高出约26%。在最高转速下,珠磨法的总蛋白量大幅减少(图1B)。在非变性条件下提取时,AFA样品的磷酸酶活性比探针超声法或最低转速下的珠磨法高出20%。在最高转速下,珠磨样品中的酶活性完全丧失(图1C),表明摩擦热导致了严重的蛋白质损伤。
图1. AFA、探针超声法和珠磨法的比较

图1. (A)AFA、探针超声法和珠磨法在最低或最高速度/功率下处理时的温度变化,(B)各方法的总蛋白得率,以及(C)残留磷酸酶活性。酵母细胞重悬于科瓦里斯N型试剂中。AFA比探针超声法和珠磨法多保留了20%的酶活性。使用最高转速的珠磨法则使酶活性完全丧失。
方法对蛋白质完整性的影响
SDS PAGE清晰显示,与AFA处理的样品相比,探针超声法和珠磨法处理的样品存在蛋白质片段化。通过条带积分光密度分析确定,在探针超声法和珠磨法样品中,分别有41%和48%的总蛋白分子量小于15 kDa。相比之下,AFA处理的样品中只有35%的蛋白质分子量小于15 kDa(图2)。
图2. 蛋白质片段化分析

图2. 8-16% SDS PAGE上的重复泳道显示探针超声法(泳道7-8)和珠磨法在最低(泳道3-4)或最高(泳道5-6)速度下导致的蛋白质片段化(已圈出)。该凝胶展示了样品过度处理的影响。上样量均一化为3 X 10^6个酵母细胞。
二维凝胶电泳
2-DE显示,与AFA样品相比,探针超声法和珠磨法样品中高分子量蛋白质有所减少。最高转速下的珠磨法导致蛋白质点数显著减少,例证了样品过度处理时产生的严重蛋白质偏好性(图3)。
图3. 酵母细胞裂解液的比较性2-DE分析
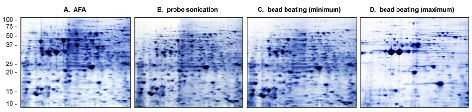
图3. 比较AFA、探针超声法和珠磨法制备的酵母细胞裂解液的2-DE图。珠磨法在最低转速下处理90秒或最高转速下处理180秒,以展示回收的蛋白质产物范围。上样量均一化为180 ug总蛋白。
结论
探针超声法和珠磨法由于其固有的对能量和热事件缺乏控制,会损伤蛋白质。科瓦里斯AFA技术精确的能量和温度控制,使得能够从酵母细胞中进行等温且可重复的蛋白质提取,这使其成为以下应用的理想机械提取技术:需要保持蛋白质天然构象和生物活性的应用,以及能够受益于可重复分析前样品制备的应用。